大河内 仁志
国立国際医療センター研究所 細胞組織再生医学研究部 部長
細胞組織再生医学研究部ではこれまでマウスのES細胞から胚様体を形成させた後、アクチビン等を添加することによりミニチュアの膵臓を誘導することができ、またアクチビンの濃度を変化させると外分泌腺と内分泌腺の割合が変化することを見いだした。ただし膵臓と同時に腸管も誘導されてしまい、血管が誘導されないために大きな臓器になりえず、サイズが制限された。次にdirect reprogrammingとして、マウスの脂肪組織由来の間葉系幹細胞に、膵臓の発生に重要な転写因子であるPdx-1を導入したところ、in vitroではインスリンを産生しなかったが、糖尿病モデルマウスに移植すると血糖の降下が認められ、生体内でインスリンを産生することを確認した。
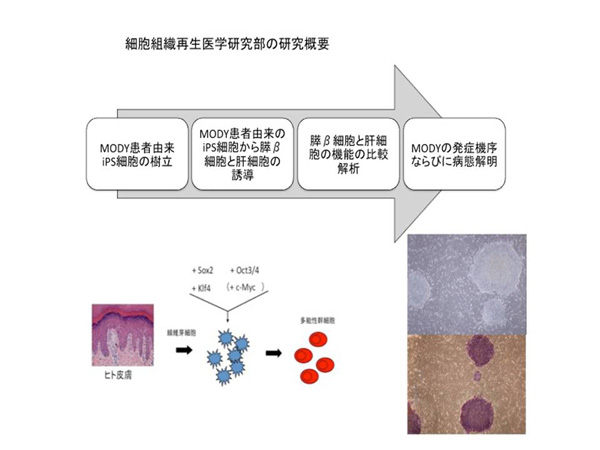
ヒトES/iPS細胞から膵臓β細胞を誘導する際に、マウスと同じ条件では再現できず、誘導効率が低いこととグルコースに応答したインスリン産生がみられないことが問題とされている。我々は1遺伝子の異常で糖尿病を発症するMODY(Maturity onset diabetes of the young)患者由来のiPS細胞を樹立した。MODYの原因遺伝子は少なくとも10種類以上知られており、MODY1(HNF4A)1例, MODY3(HNF1A)2例, MODY5(HNF1B)1例の合計4症例の皮膚線維芽細胞に対して、レトロウイルス法またはセンダイウイルス法を用いて山中4因子を導入し、iPS細胞を樹立した。未分化マーカーの発現を確認するとともに、SCIDマウスに移植して奇形種の形成を確認した。ヒトiPS細胞から膵臓β細胞を効率よく誘導することができるようになれば、正常人由来の膵臓β細胞と患者由来の膵臓β細胞の機能を比較することによって、インスリン分泌不全を呈するMODYの病態解明につながることが期待される。